A02-1 機動性DNAエレメントの生殖系列の伝達様式と減数分裂チェックによる制御

研究代表者
石黒 啓一郎 Ishiguro Kei-ichiro
千葉大学 大学院医学研究院・疾患生命学 教授 / cNIVR 動物病態学 部門長

研究分担者
横林 しほり Yokobayashi Shihori
理化学研究所 生命医科学研究センター エピゲノムダイナミクス理研ECL研究チーム 理研ECL研究チームリーダー
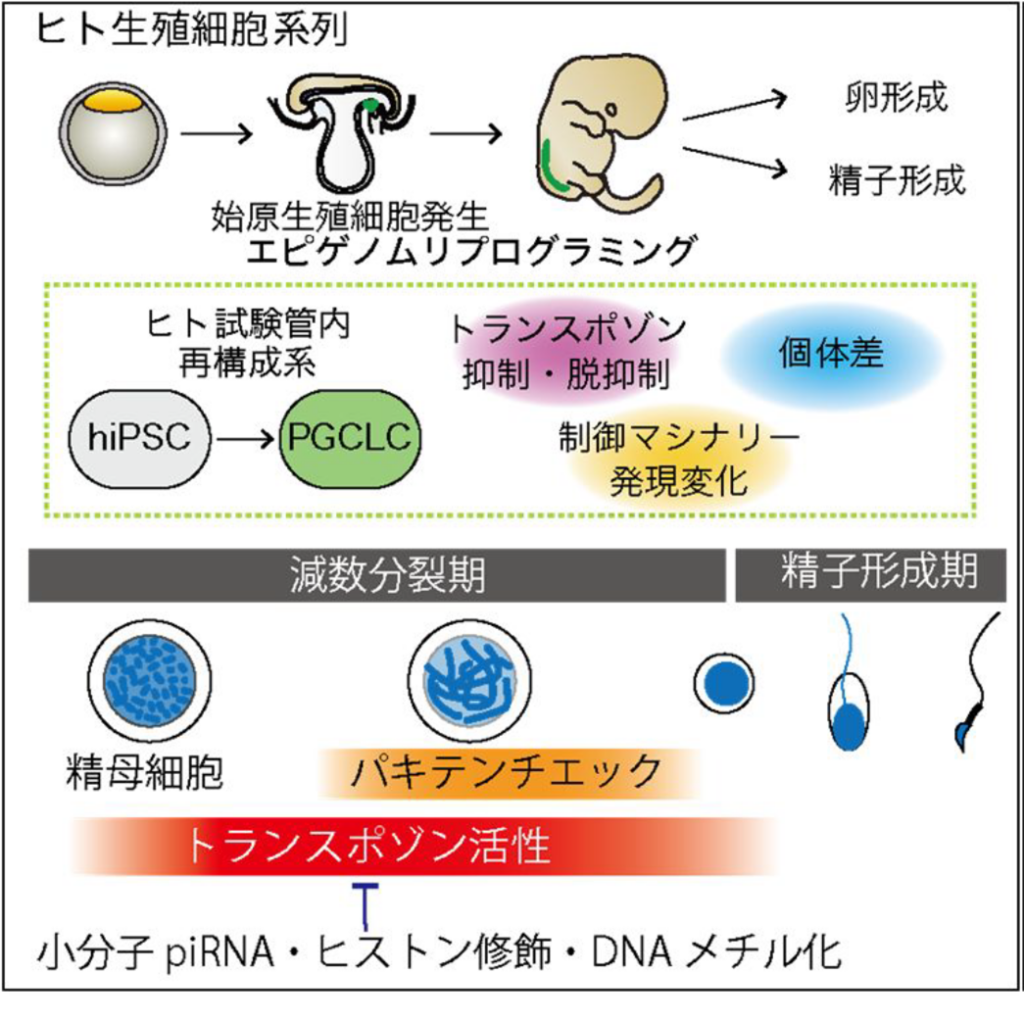
マウスの生殖細胞は、個体の全発生過程を通して一過的にトランスポゾンの発現バーストが活発となる時期として知られる。生殖細胞は配偶子形成へのリスクを抱えながらも、ゲノムの可変性を誘導するために、あえてトランスポゾンの活性化を容認している可能性がある。
一方、生殖細胞の減数分裂期は、パキテンチェック機構によりトランスポゾン活性化の高いハードルとしても働く。本研究では、(1) 生殖細胞が減数分裂期に機動性DNAエレメントをあえて活性化する分子的仕組み、(2) 機動性DNAエレメントに対してパキテンチェックを許容する仕組み、これら2つの角度から検討する。 マウスでは、トランスポゾン抑制に働くPIWI-piRNA機構は精子形成過程で重要な働きを持つ。一方、ハムスターやヒトなど、マウス以外の哺乳類で卵子におけるPIWIの発現が示唆されており、哺乳類雌性生殖系列におけるトランスポゾンの挙動やその抑制機構には種による影響が大きいと考えられる。また、ヒトではトランスポゾン関連領域のクロマチン状態における個体差も示唆されているが、詳細はわかっていない。横林は、ヒトiPS細胞を起点とした始原生殖細胞発生過程の試験管内再構成系をモデルとして用い、ヒト生殖系列におけるトランスポゾン因子とその制御因子(PIWIやKZFPファミリー等抑制複合体や小分子RNA)の挙動の理解を目指す。異なるゲノム由来のiPS細胞株を起点として比較解析することにより、トランスポゾンダイナミクスにおける普遍性や多様性を解析し、次世代継承に関わるヒト個体差の理解につながる所見を得ることを目指す。
研究業績 ※責任著者
石黒 啓一郎
- Yoshimura S, et al., ※Ishiguro K.
Atypical heat shock transcription factor HSF5 is critical for male meiotic prophase under non-stress conditions.
Nature Commun. 15(2024) - Alavattam KG, et al., ※Ishiguro K.
ATF7IP2/MCAF2 directs H3K9 methylation and meiotic gene regulation in the male germline.
Genes & Dev 38, 115- 130 (2024) - Shimada R, et al., ※Ishiguro K.
STRA8–RB interaction is required for timely entry of meiosis in mouse female germ cells.
Nature Commun. 14, 6443 (2023) - Horisawa-Takada Y, et al., ※Ishiguro K.
Meiosis-specific ZFP541 repressor complex promotes meiotic prophase exit during mouse spermatogenesis.
Nature Commun. 12, 3184 (2021) - Fujiwara Y, et al., ※Ishiguro K.
Meiotic cohesins mediate initial loading of HORMAD1 to the chromosomes and coordinate SC formation during meiotic prophase.
PLOS Genetics 16, e1009048 (2020) - Takemoto K, et al., ※Ishiguro K.
Meiosis-specific C19orf57/ 4930432K21Rik/ BRME1 modulates localization of RAD51 and DMC1 to DSBs in mouse meiotic recombination.
Cell Reports 31,107686 (2020) - ※Ishiguro K, et al.
MEIOSIN directs the switch from mitosis to meiosis in mammalian germ cells.
Dev. Cell 52, 429-445 (2020) - Kim J, et al., Ishiguro K.
Meikin is a conserved regulator of meiosis-I-specific kinetochore function.
Nature 517, 466-471 (2015) - ※Ishiguro K., et al.
Meiosis-specific cohesin mediates homolog recognition in mouse spermatocytes.
Genes & Dev. 28, 594-607 (2014)
横林 しほり
- Nagano M, et al., Yokobayashi S.
Nucleome programming is required for the foundation of totipotency in mammalian germline development.
The EMBO Journal, 41: e110600 (2022) - ※Yokobayashi S, et al.
Inherent genomic properties underlie the epigenomic heterogeneity of human induced pluripotent stem cells.
Cell Reports, 37: 109909 (2021) - ※Yokobayashi S, et al.
Reconstitution of germ cell development in vitro.
Cell Biology of the Ovary, Springer, Singapore (2018) - ※Yokobayashi S, et al.
Clonal variation of human induced pluripotent stem cells for induction into the germ cell fate.
Biology of Reproduction, 96: 1154-1166 (2017) - Sasaki K, et al., Yokobayashi S.
Robust In Vitro Induction of Human Germ Cell Fate from Pluripotent Stem Cells
Cell Stem Cell, 17: 178-94 (2015) - Yokobayashi S, et al.
PRC1 coordinates timing of sexual differentiation of female primordial germ cells.
Nature, 495: 236-40 (2013) - Terranova R, et al., Yokobayashi S.
Polycomb group proteins Ezh2 and Rnf2 direct genomic contraction and imprinted repression in early mouse embryos.
Developmental Cell, 15: 668-79 (2008)
