A01-3 ケモテクノロジーを駆使した機動性DNAエレメントの解析と制御

研究代表者
林 剛介 Hayashi Gosuke
名古屋大学大学院工学研究科 生命分子工学専攻 准教授

研究分担者
越阪部 晃永 Osakabe Akihisa
千葉大学 国際高等研究基幹/理学研究院 生物学研究部門 テニュアトラック准教授
- researchmaphttps://researchmap.jp/7000001660
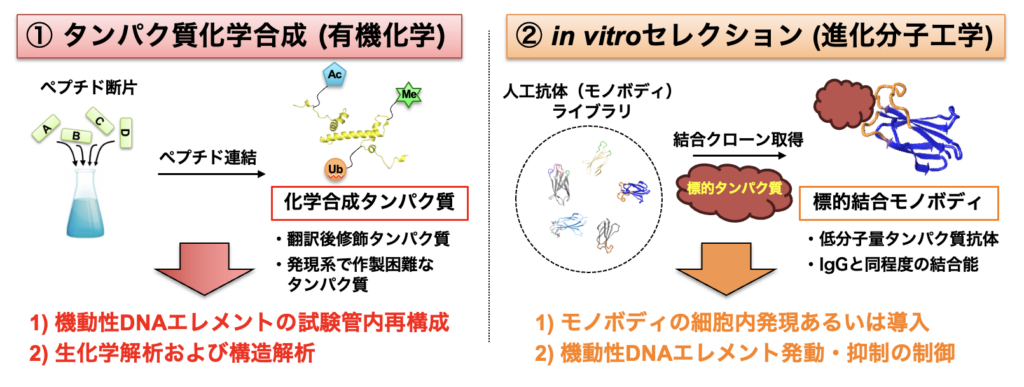
本研究では、最先端ケモテクノロジーを駆使して機動性DNAエレメントの発動・抑制メカニズムを分子レベルで解析し、さらに得られた知見から新たな制御技術を開発することを目的とする。林の有する「タンパク質化学合成法(ケモテク①)」によって、発現系では作製困難なタンパク質群(翻訳後修飾タンパク質や天然変性タンパク質、宿主毒性をもつタンパク質、など)を作製し、領域内共同研究を活用しながら生化学解析や構造解析を展開する。例えば、機動性DNAエレメントの発動・抑制に関与するエピゲノム修飾(メチル化やアセチル化、ユビキチン化、など)を含むヒストンなどクロマチン関連タンパク質を化学合成し、越阪部の有するクロマチン再構成技術によって細胞内環境を反映したクロマチンを試験管内で再構成して生化学解析を行うことで、その発動・抑制分子機構を明らかにする。さらに植物個体から抽出したゲノム、クロマチンを基質にした生化学解析を融合することで、エピゲノムを介したトランスポゾンの宿主ゲノム標的分子機構を明らかにする。また、もう一つの基盤技術である「in vitroセレクション法(ケモテク②)」によって、機動性DNAエレメントの発動・抑制に関わるタンパク質に選択的に結合・阻害する人工抗体モノボディ(100アミノ酸程度のタンパク質抗体)を取得し、生細胞内で発現させることで標的タンパク質がトランスポゾン活性に与える影響を解析する。さらには、in vitroセレクション法をトランスポゾン制御因子の分子進化に応用し、狙ったDNAエレメントの発動・抑制を人為的に制御可能な新技術を開発する。
研究業績 ※責任著者
林 剛介
- ※Hayashi G, et al.
Generating a mirror-image monobody targeting MCP-1 via TRAP display and chemical protein synthesis.
Nature Communications 15, 10723 (2024) - Nakatsu K, et al., ※Hayashi G.
Repetitive Thiazolidine Deprotection Using a Thioester-Compatible Aldehyde Scavenger for One-Pot Multiple Peptide Ligation.
Angewandte Chemie International Edition 61, e202206240. (2022) - Kamo N, et al., ※Hayashi G.
S Organoruthenium-Catalyzed Chemical Protein Synthesis to Elucidate the Functions of Epigenetic Modifications on Heterochromatin Factors.
Chemical Science 12, 5926-5937. (2021) - Nakatsu K, et al., ※Hayashi G.
Toolbox for Chemically Synthesized Histone Proteins
Current Opinion in Chemical Biology 58, 10-19. (2020) - Kondo T, et al., Hayashi G.
Antibody-like proteins that capture and neutralize SARS-CoV-2.
Science Advances 6, eabd3916. (2020)
越阪部 晃永
- ※Osakabe A, et al.
Molecular and structural basis of the chromatin remodeling activity by Arabidopsis DDM1.
Nature Communications 15, 5187 (2024) - ※Osakabe A. and Molaro A.
Histone renegades: Unusual H2A histone variants in plants and animals.
Seminars in Cell & Developmental Biology, 135, 35-42. (2023) - Osakabe A, et al.
The chromatin remodeler DDM1 prevents transposon mobility through deposition of histone variant H2A.W.
Nature Cell Biology, 23, 391-400 (2021) - Osakabe A, et al.
Histone H2A variants confer specific properties to nucleosomes and impact on chromatin accessibility.
Nucleic Acids Research, 46, 7675-7685. (2018) - Kato D, Osakabe A, et al.
Crystal structure of the overlapping dinucleosome composed of hexasome and octasome.
Science, 356, 205-208 (2017)
